NOTA: Si tu nivel de física y matemáticas es bajo, ¡simplemente ignora las fórmulas! Eso no te va a impedir entender la entrada
¿Por qué la savia asciende por el interior de los troncos, si la gravedad "tira" de ella hacia abajo? ¿Por qué las gotas de lluvia tienen esa forma? ¿Por qué las avispas se pueden "sujetar" sobre la superficie del agua? ¿Por qué los líquidos mojan?
¿Por qué la savia asciende por el interior de los troncos, si la gravedad "tira" de ella hacia abajo? ¿Por qué las gotas de lluvia tienen esa forma? ¿Por qué las avispas se pueden "sujetar" sobre la superficie del agua? ¿Por qué los líquidos mojan?
Todas estas preguntas se contestan de modo fundamental por el mismo fenómeno físico: la tensión superficial.
- Introducción
- Introducción
La tensión superficial es un fenómeno que se da principalmente en líquidos y es debido a las fuerzas de cohesión entre las moléculas; por ejemplo, de los puentes de hidrógeno en el caso del agua, los enlaces metálicos en el mercurio o las fuerzas de Van der Waals en gases (es decir, estamos hablando de fuerzas causadas en su mayoría por atracción electromagnética, que recordemos que es mayor que la fuerza de la gravedad, razón por la que un imán pegado en la nevera no se cae).
Pensemos en un vaso de agua. Mientras que la mayor parte de las moléculas de agua se encuentran en el interior del vaso, rodeadas de otras moléculas de agua, las que se encuentran en la superficie están en contacto con el aire en la parte superior y con otras moléculas de agua tanto por los lados como por la parte inferior. Así, aquellas moléculas que se encuentran rodeadas completamente por moléculas similares podríamos decir que se encuentran en equilibrio, puesto que todas las moléculas las atraen por igual, y en todas direcciones. Sin embargo, esto no es así en las moléculas de agua de la superficie, pues se encuentran en la parte inferior y en los laterales con las moléculas de agua que las atraen fuertemente, debido a la intensidad de los puentes de hidrógeno, y en la parte superior se encuentran con una atracción muy débil debida a los gases del aire (atmósfera).
Esto significa que hay una fuerza neta entre estas moléculas de la superficie; es decir, que están muy fuertemente unidas entre sí, en comparación con las que se encuentran en el seno del fluido, formando una película que es difícil de separar.
El que se forme esta película permite que las avispas puedan posarse sobre la superficie de los lagos y las piscinas para beber, o que los zapateros (Gerris lacustris) puedan desplazarse sobre ellas.
Así que la próxima vez que veas a un insecto posándose o "caminando" sobre el agua, recuerda que se debe a que las moléculas de la superficie están unidas muy fuerte entre sí porque el aire de arriba las atrae menos que las moléculas de agua que se encuentran a sus lados y debajo de ellas.
Por lo tanto, la energía no es la misma para una molécula rodeada de moléculas similares que la de otra que no lo está. A esta diferencia de energías se le conoce como energía superficial, cuya expresión matemática es:
U_{sup}= \tau_{sup} \cdot S
donde \tau_{sup} es el coeficiente de tensión superficial que nos permite hacernos una idea de lo fuerte que están unidas entre sí las moléculas de una superficie y S es la superficie del líquido. ¡Esto es importante! Este es un fenómeno superficial, no volumétrico. Es decir, lo único que importa es la superficie del fluido, independientemente del volumen total.
 |
| Los puentes de hidrógeno son los responsables de que esta sustancia tenga una temperatura de ebullición relativamente alta, así como de que las moléculas tengan una fuerza de atracción entre sí (de cohesión) importante, lo que origina el fenómeno de la tensión superficial [Fuente imagen] |
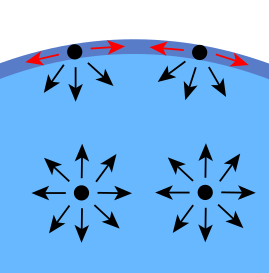 |
| En las moléculas de agua que se encuentran en el seno del fluido, rodeadas de otras semejantes, no hay ninguna fuerza neta, puesto que si una molécula la atrae hacia arriba, al estar completamente rodeada, hay otra que tira de ella hacia abajo con igual intensidad. El resultado es que están en equilibrio. En las moléculas de la superficie, sin embargo, hay una fuerza neta, puesto que las moléculas de aire apenas compensan la atracción de las otras moléculas de agua. Esto hace que esas moléculas de la superficie estén unidas entre sí muy fuertemente, de forma que es difícil separarlas [Fuente imagen] |
El que se forme esta película permite que las avispas puedan posarse sobre la superficie de los lagos y las piscinas para beber, o que los zapateros (Gerris lacustris) puedan desplazarse sobre ellas.
Así que la próxima vez que veas a un insecto posándose o "caminando" sobre el agua, recuerda que se debe a que las moléculas de la superficie están unidas muy fuerte entre sí porque el aire de arriba las atrae menos que las moléculas de agua que se encuentran a sus lados y debajo de ellas.
 |
| El zapatero (Gerris lacustris), así como otros insectos, puede desplazarse sobre el agua porque su peso no es fuerza suficiente como para romper la fuerte película de agua formada por la tensión superficial [Fuente imagen] |
Por lo tanto, la energía no es la misma para una molécula rodeada de moléculas similares que la de otra que no lo está. A esta diferencia de energías se le conoce como energía superficial, cuya expresión matemática es:
U_{sup}= \tau_{sup} \cdot S
donde \tau_{sup} es el coeficiente de tensión superficial que nos permite hacernos una idea de lo fuerte que están unidas entre sí las moléculas de una superficie y S es la superficie del líquido. ¡Esto es importante! Este es un fenómeno superficial, no volumétrico. Es decir, lo único que importa es la superficie del fluido, independientemente del volumen total.
 |
| ¿En cuál de estos recipientes va a ser mayor la tensión superficial? Respuesta: En todos es la misma, porque la tensión superficial no depende del volumen del líquido, sino de su superficie S |
De la misma forma que hay una expresión para la energía superficial, la hay para la fuerza con la que se atraen las moléculas de la película de la superficie. ¿Por qué? ¿Recuerdas lo que hablamos en la entrada de la membrana plasmática [transporte de moléculas pequeñas] sobre el gradiente? Siempre que hay una diferencia de energía (ya sea térmica, eléctrica, etc.), va a aparecer una fuerza cuya función es la de hacer que la situación se homogeneice para llegar a la mínima energía posible (¡es lo que siempre busca la naturaleza! De esto se extrae, por ejemplo, que se nos agote la batería del móvil [pues las cargas de los condensadores que contiene tienden a juntarse para disminuir la energía eléctrica todo lo posible] o que las moléculas prefieran ciertas conformaciones frente a otras [¡arriba las conformaciones ecuatoriales frente a las axiales!] o que unos compuestos sean más ácidos que otros [esto se basa en la estabilidad que resulta de intentar minimizar la energía eléctrica en el anión fruto de la acidificación]. Por lo tanto, podemos expresar:
\vec{F}_{sup} = - \vec{\nabla} U_{sup}
donde \vec{\nabla} es el símbolo que utilizan los matemáticos y los físicos para expresar lo que es un gradiente y el signo negativo nos quiere indicar que la fuerza tiende a disminuir la diferencia (gradiente) de la energía superficial (¡físicos!: Como veis, esto nos indica que la fuerza deriva de un potencial: es conservativa).
Como lo que se busca es la mínima energía posible, las gotas tienen esa forma. En el espacio, por ejemplo, puede verse cómo las gotas de agua son completamente esféricas - las que nosotros vemos están deformadas porque la gravedad las alaga, originando esa forma de lágrima -. Esto se debe a que la esfera es la forma geométrica que, dado un volumen fijo, tiene la menor superficie posible. Y como hemos visto, la tensión superficial no depende del volumen, sino de la superficie. Por ello, la esfera es la forma para la cual la energía superficial es menor.
Esto es importante, porque existe otro tipo de fuerza, antagónico al de la cohesión: la fuerza de adhesión, que tiende a que moléculas diferentes se atraigan. Si has tenido un termómetro de mercurio y, como yo, eres algo torpe, habrás podido comprobar lo difícil que es recoger el mercurio del suelo: se forman bolitas completamente independientes entre sí, que no pueden ser absorbidas por una bayeta. Una de tus opciones es ir empujando las pequeñas bolitas hasta hacer una más grande que sea más fácil de coger (el mercurio es tóxico, no lo intentes tocar con la mano desnuda).
| El mercurio tiene una tensión superficial muy elevada. Las fuerzas de adhesión son despreciables frente a las de cohesión, razón por la que forma esferas [Fuente imagen] |
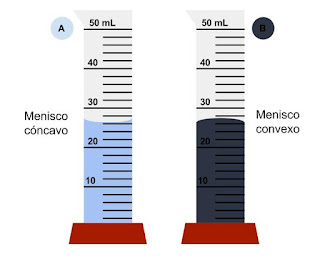 |
| Formación del menisco en agua (izquierda) y mercurio (derecha) [Fuente] |
En cambio, en el caso del agua, por ejemplo, las fuerzas de cohesión son menores que las de adhesión y su menisco tiene la forma inversa. Esto es lo que permite que el agua ascienda por los canales de las plantas (xilema), ya que las moléculas de estos canales "tiran" más de las partículas de agua que lo que la fuerza de gravedad tira hacia abajo de ellas.
 |
| Las fuerzas que atraen a las moléculas de agua y las del tubo son mayores que aquellas que atraen a las moléculas de agua entre sí, razón por las que el líquido asciende. A este fenómeno se le llama capilaridad [Fuente imagen] |
- Medición de la tensión superficial (si te aburre, ¡sáltate esta parte!)
Si vas a ir a algún laboratorio de física, ya sea en el grado de Química, de Biología o desde la propia Física, lo más seguro es que tengas una práctica para medir la tensión superficial. El procedimiento más común es utilizar el método de Nouy, más que nada porque es fácil y barato. Nosotros lo haremos para medir la tensión superficial del agua según vamos variando la tempertatura (de 0ºC - 85ºC) y al añadir jabón.
 |
| Montaje experimental |
\sum \vec{F}_{neta}= \vec{T} +\vec{P} + \vec{F}_{sup} = 0 \to T - P -F_{sup} = 0
\boxed{T= P+F_{sup}}
\boxed{T= P+F_{sup}}
Es decir, el dinamómetro lo que marca es la tensión,T, que percibe, por lo que para calcular la fuerza que se debe a la tensión superficial habrás de restarle a la tensión el peso del anillo.
Esta parte es un poco más técnica, así que, si quieres, fíjate únicamente en las expresiones recuadradas... ¡o pasa a la siguiente sección! ¿Cómo calcular, a partir de aquí el valor del coeficiente de la tensión superficial? Si recordáis lo visto en la ecuación ():
U_{sup} = \tau_{sup} \cdot S
donde aquí S representa la superficie del fluido encerrada por el anillo: S= \pi r_m^2 (r_m es el radio medio del anillo).
Entonces, la fuerza que estamos midiendo es:
\vec{F}_{sup}=- 2 \times \vec{\nabla} U_{sup} \to F_{sup} = -2 \times \frac{\partial (\tau_{sup} 2 \pi r_m^2)}{\partial r_m}
¿De dónde sale el 2? De que la fuerza actúa tanto sobre la cara interna del anillo como por la externa (hay dos superficies). Para hacer el gradiente, hemos tenido en cuenta que lo único que varía es el radio (¡físicos!: el gradiente no es recomendable hacerlo en cartesianas. He dejado las parciales en vez de poner derivadas absolutas para remarcar esto). Entonces:
\boxed{F_{sup} = \tau_{sup} \cdot4 \pi r_m}
Despejando de esta ecuación podremos fácilmente calcular el coeficiente.
- Cómo se comporta el coeficiente con la temperatura y el jabón (¡esto es lo interesante!)
1. Variación con la temperatura
Cuanta mayor temperatura posee un cuerpo, más se mueven las partículas que lo constituyen (mayor energía cinética. Para una molécula de un gas ideal, de hecho, la relación es E_k= \frac{3}{2}K_bT, donde K_b es la constante de Bolztman). Y cuanto más se mueven, más se agitan, menos unidas están entre sí y menores son sus fuerzas de cohesión.
Esta es la principal diferencia entre el vapor de agua, el agua líquida y el hielo: en el vapor agua, las moléculas están a temperaturas relativamente altas, de formas que las fuerzas de cohesión entre sí son despreciables. En el hielo, así como en el resto de sólidos, las partículas están limitadas a poco más que movimientos de vibración: las fuerzas de cohesión son muy fuertes.
Por lo tanto, si la tensión superficial se debe a que las moléculas de agua se atraen muy fuertemente entre sí, cuanto mayor sea la temperatura, menos se atraerán y menor será la tensión superficial. Es decir, la tensión superficial disminuye con la temperatura. Esta es la razón por las que se lava mejor con el agua caliente: como las partículas están menos cohesionadas entre sí (hay menor tensión superficial), el agua "moja" más y es capaz de penetrar por canales más estrechos. He aquí la clave: cuanto menor es la tensión superficial [menores fuerzas de cohesión], más mojan los líquidos, puesto que las fuerzas que los atraen hacia el material que queremos mojar (fuerzas de adhesión) son mayores.
Es también importante señalar el curioso caso del agua: el hielo (forma sólida) flota sobre el agua (forma líquida). Si recuerdas a Arquímedes, esto significa que el hielo es menos denso que el agua (dicho brutamente, el agua líquida "pesa" más que el hielo y por eso se hunde con respecto al hielo). Sin embargo, si los sólidos son formas en las que las partículas están muy juntas entre sí, deberíamos esperar que la densidad fuera mayor. Esto es así como norma general, pero el agua se la salta. ¿A qué se debe este fenómeno? Ciertamente, y como buen sólido, en el hielo las moléculas de aguas están prácticamente fijas, pero en una estructura que deja muchos huecos entre sí. Son tan grandes, que superan los huecos que dejan las moléculas de agua en estado líquido.
Podemos ver que la densidad del agua va aumentando a medida que disminuimos la temperatura (las moléculas se van quedando más quitas y unidas), llegando a los 4ºC - donde alcanza su máximo - cuando, de repente, la densidad comienza a disminuir (así hasta que llega a hielo), dando lugar al fenómeno extraño [anomalía del agua] del que hemos estado hablando.
¿Dependerá la tensión superficial de la densidad del agua? Quiero decir, si la tensión superficial aumenta cuanto más juntas estén las partículas (mayores sean las fuerzas de cohesión), cabría esperar que la tensión superficial fuera aumentando hasta los 4ºC, al igual que la densidad, y comenzara a bajar. Es decir, parece lógico que la tensión normal sigue alguna ley de proporcionalidad con la densidad. ¿Qué nos dicen los datos experimentales?
Es decir, experimentalmente no se aprecia ninguna relación entre la densidad del agua y el valor de la tensión superficial de la misma. Esto podría deberse a dos causas:
1. Ciertamente, la tensión superficial de un líquido y su densidad son independientes entre sí.
2. Nuestros experimentos no tienen la capacidad suficiente como para detectar dicha dependencia.
Y así es la ciencia. Hasta que no se demuestre experimentalmente que dependen, no podemos decir mucho más.
2. Variación con el tensioactivo (jabón)
El jabón está compuesto principalmente por unos lípidos llamados acilglicéridos que constan de una cola hidrófoba (inmiscible con el agua) y una cabeza polar, hidrófila. Debido a esta parte, las moléculas rodean al agua, evitando su interacción con otras moléculas de agua - y, por ello, disminuyendo las fuerzas de cohesión totales de la solución jabonosa -.
Hemos observado que la tensión superficial disminuye hasta un 28% al añadir una cantidad Q de jabón. La variación es mayor a medida que vamos aumentando la concentración de tensioactivo en la solución jabonosa.
Por lo tanto, podemos ver que, tal y como esperábamos, la tensión superficial disminuye al añadirle un tensioactivo (jabón).
Esta parte es un poco más técnica, así que, si quieres, fíjate únicamente en las expresiones recuadradas... ¡o pasa a la siguiente sección! ¿Cómo calcular, a partir de aquí el valor del coeficiente de la tensión superficial? Si recordáis lo visto en la ecuación ():
U_{sup} = \tau_{sup} \cdot S
donde aquí S representa la superficie del fluido encerrada por el anillo: S= \pi r_m^2 (r_m es el radio medio del anillo).
Entonces, la fuerza que estamos midiendo es:
\vec{F}_{sup}=- 2 \times \vec{\nabla} U_{sup} \to F_{sup} = -2 \times \frac{\partial (\tau_{sup} 2 \pi r_m^2)}{\partial r_m}
¿De dónde sale el 2? De que la fuerza actúa tanto sobre la cara interna del anillo como por la externa (hay dos superficies). Para hacer el gradiente, hemos tenido en cuenta que lo único que varía es el radio (¡físicos!: el gradiente no es recomendable hacerlo en cartesianas. He dejado las parciales en vez de poner derivadas absolutas para remarcar esto). Entonces:
\boxed{F_{sup} = \tau_{sup} \cdot4 \pi r_m}
Despejando de esta ecuación podremos fácilmente calcular el coeficiente.
- Cómo se comporta el coeficiente con la temperatura y el jabón (¡esto es lo interesante!)
1. Variación con la temperatura
Cuanta mayor temperatura posee un cuerpo, más se mueven las partículas que lo constituyen (mayor energía cinética. Para una molécula de un gas ideal, de hecho, la relación es E_k= \frac{3}{2}K_bT, donde K_b es la constante de Bolztman). Y cuanto más se mueven, más se agitan, menos unidas están entre sí y menores son sus fuerzas de cohesión.
 |
| Al aumentar la temperatura, aumenta el movimiento de las partículas, de forma que cada vez están menos unidas y las fuerzas que las cohesionan son menores [Fuente imagen] |
Esta es la principal diferencia entre el vapor de agua, el agua líquida y el hielo: en el vapor agua, las moléculas están a temperaturas relativamente altas, de formas que las fuerzas de cohesión entre sí son despreciables. En el hielo, así como en el resto de sólidos, las partículas están limitadas a poco más que movimientos de vibración: las fuerzas de cohesión son muy fuertes.
 |
| La principal diferencia entre un sólido, un líquido y un gas son las fuerzas de cohesión entre las moléculas. Así, en un sólido son muy fuertes, y éstas apenas se mueven. En un gas, son muy débiles - de hecho, en un gas ideal no hay -. [Fuente imagen] |
Es también importante señalar el curioso caso del agua: el hielo (forma sólida) flota sobre el agua (forma líquida). Si recuerdas a Arquímedes, esto significa que el hielo es menos denso que el agua (dicho brutamente, el agua líquida "pesa" más que el hielo y por eso se hunde con respecto al hielo). Sin embargo, si los sólidos son formas en las que las partículas están muy juntas entre sí, deberíamos esperar que la densidad fuera mayor. Esto es así como norma general, pero el agua se la salta. ¿A qué se debe este fenómeno? Ciertamente, y como buen sólido, en el hielo las moléculas de aguas están prácticamente fijas, pero en una estructura que deja muchos huecos entre sí. Son tan grandes, que superan los huecos que dejan las moléculas de agua en estado líquido.
 |
| En el hielo, las moléculas de agua tienen una estructura muy ordenada, en la cual la distancia entre las propias moléculas es mayor que en el caso del agua líquida. Esto es lo que hace que el hielo sea menos denso que el agua - y, por ende, que flote sobre ella como ocurre con los icebergs -. [Fuente imagen] |
 |
| Imagen de la anomalía térmica del agua (cómo el máximo de la densidad se alcanza a los 4ºC para luego disminuir, a pesar de acercarse a la fase sólida) [Fuente imagen] |
Es decir, experimentalmente no se aprecia ninguna relación entre la densidad del agua y el valor de la tensión superficial de la misma. Esto podría deberse a dos causas:
1. Ciertamente, la tensión superficial de un líquido y su densidad son independientes entre sí.
2. Nuestros experimentos no tienen la capacidad suficiente como para detectar dicha dependencia.
Y así es la ciencia. Hasta que no se demuestre experimentalmente que dependen, no podemos decir mucho más.
2. Variación con el tensioactivo (jabón)
El jabón está compuesto principalmente por unos lípidos llamados acilglicéridos que constan de una cola hidrófoba (inmiscible con el agua) y una cabeza polar, hidrófila. Debido a esta parte, las moléculas rodean al agua, evitando su interacción con otras moléculas de agua - y, por ello, disminuyendo las fuerzas de cohesión totales de la solución jabonosa -.
Hemos observado que la tensión superficial disminuye hasta un 28% al añadir una cantidad Q de jabón. La variación es mayor a medida que vamos aumentando la concentración de tensioactivo en la solución jabonosa.
Por lo tanto, podemos ver que, tal y como esperábamos, la tensión superficial disminuye al añadirle un tensioactivo (jabón).






Buenas, que entrada tan interesante! Decirte que tu blog me ha encantado.
ResponderEliminarA propósito que he leído que estás estudiando física en la UAM (mi verdadero sueño), si no es mucho preguntar, sabes cómo va el tema de convalidaciones de una carrera a otra? Yo este año estudio primero de ingeniería en la UCM porque no me ha dado la nota para física, pero tengo la esperanza de poder cambiarme.
Gracias y un saludo!
Julia
P.D: yo también tengo un blog del estilo pero en plan cutre xD
Hola! Me alegro que te haya gustado (miraré entonces tu blog y te publicaré algo yo también por ahí, si te parece bien ;) ). Pues mira, más o menos sí sé cómo van las convalidaciones porque yo me cambié, aunque dentro de la UAM (el procedimiento, especialmente en Madrid, será más o menos el mismo).
EliminarTienes que presentar un formulario que encontrarás en Internet (o bien en la web de la facultad a la que te vas a cambiar o bien en la general de la universidad) y presentarlo dentro de los plazos. Entonces se reúne una comisión de convalidación, observa los planes de estudios de la carrera de procedencia y de aquella a la que te quieres cambiar y decide si te convalida o no. Te convalidan asignaturas que sean iguales y también pueden convalidarte asignaturas que no tienen nada que ver con tu carrera por créditos de optativas (hay un límite para el nº de créditos no "intrínsecamente" de tu carrera que puedes convalidar). Lo mejor es, entonces, leerte la parte de convalidación de tu uni - que vendrá en Internet - y contactar con secretaría y luego nada, estar pendiente a la resolución de la comisión.
Si el cambio lo haces a la UAM, ya puedo ayudarte más específicamente porque yo lo hice. Puedes contactar conmigo por aquí:
- https://twitter.com/PrionicProtein
- https://curiouscat.me/Prion
Un saludo, y muchas suerte :)